(Trang 108)
MỤC TIÊU
- Nêu được trạng thái tự nhiên của nguyên tố nhóm IA.
- Nêu được xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của kim loại nhóm IA.
- Giải thích được nguyên nhân khối lượng riêng nhỏ và độ cứng thấp của kim loại nhóm IA.
- Giải thích được nguyên nhân kim loại nhóm IA có tính khử mạnh hơn so với các nhóm kim loại khác.
- Thông qua mô tả thí nghiệm (hoặc quan sát qua video), nêu được mức độ phản ứng tăng dần từ lithium, sodium, potassium khi chúng phản ứng với nước, chlorine và oxygen.
- Trình bày được cách bảo quản kim loại nhóm IA.
- Giải thích được trạng thái tồn tại của nguyên tố nhóm IA trong tự nhiên.
- Nêu được khả năng tan trong nước của các hợp chất nhóm IA.
- Thực hiện được thí nghiệm (hoặc qua quan sát video thí nghiệm) phân biệt các ion Li+, Na+, K+ bằng màu ngọn lửa.
- Tìm hiểu và trình bày được ứng dụng của sodium chloride.
- Trình bày được quá trình điện phân dung dịch sodium chloride và các sản phẩm cơ bản của công nghiệp chlorine – kiềm.
- Giải thích được các ứng dụng phổ biến của sodium hydrogencarbonate (natri hiđrocacbonat), sodium carbonate (natri cacbonat) và phương pháp Solvay sản xuất soda.
?
Các kim loại nhóm IA (nhóm kim loại kiềm) và hợp chất của chúng có nhiều ứng dụng như: sản xuất pin lithium, nước Javel, phân kali, tế bào quang điện, đồng hồ nguyên tử,...
Vậy, đơn chất nhóm IA có đặc điểm gì nổi bật về tính chất vật lí và tính chất hoá học? Các hợp chất nhóm IA quan trọng như xút, soda được sản xuất trong công nghiệp như thế nào?

| 3 Li Lithium | 11 Na Sodium | 19 K Potassium | 37 Rb Rubidium | 55 Cs Cesium | 87 Fr Francium |
|
Pin lithium |
Baking soda |
Thuốc nổ |
Pháo bông |
Đồng hồ nguyên tử |
Chất phóng xạ |
Hình 24.1. Một số ứng dụng của nguyên tố kim loại nhóm IA
(Trang 109)
I. ĐƠN CHẤT NHÓM IA
1. Đặc điểm chung
Một số đại lượng đặc trưng của các nguyên tố nhóm IA được trình bày trong Bảng 24.1.
Bảng 24.1. Một số đại lượng đặc trưng của các nguyên tố nhóm IA
| Nguyên tử | Số hiệu nguyên tử | Tên gọi | Cấu hình electron | Bán kính nguyên tử (pm)(1) | Thế điện cực chuẩn (V)(2) |
| Li | 3 | Lithium | [He]2s1 | 152 | -3,040 |
| Na | 11 | Sodium | [Ne]3s1 | 186 | -2,713 |
| K | 19 | Potassium | [Ar]4s1 | 227 | -2,924 |
| Rb | 37 | Rubidium | [Kr]5s1 | 248 | -2,924 |
| Cs | 55 | Cesium | [Car]6s1 | 265 | -2,923 |
Thực hiện các yêu cầu sau:
1. Nhận xét về xu hướng biến đổi bán kính nguyên tử của nguyên tố nhóm IA.
2. Cho biết: xu hướng biến đổi tính khử từ Li đến Cs; số oxi hoá đặc trưng của nguyên tử kim loại nhóm IA.
Nguyên tố nhóm IA là những nguyên tố s, chỉ có 1 electron hoá trị ở phân lớp ns¹ và đứng đầu mỗi chu kì tương ứng. Kim loại nhóm IA có thế điện cực chuẩn Em/m rất nhỏ nên dễ tách electron hoá trị ra khỏi nguyên tử. Vì vậy, trong các phản ứng hoá học, chúng dễ nhường 1 electron, thể hiện tính khử rất mạnh:
M → M+ + 1e
Trong hợp chất, nguyên tử kim loại nhóm IA chỉ thể hiện số oxi hoá +1.
2. Trạng thái tự nhiên
Trong tự nhiên, các nguyên tố nhóm IA chỉ tồn tại ở dạng hợp chất (chủ yếu là dạng muối). Sodium và potassium là hai nguyên tố phổ biến trong vỏ Trái Đất, có nhiều trong nước biển, mỏ muối, quặng halite (NaCl), quặng sylvinite (NaCI.KCI).
?
1. Tại sao các nguyên tố kim loại nhóm IA không tồn tại ở dạng đơn chất trong tự nhiên?
(1) Nguồn: Silberberg, M. S. 2007. Nguyên lý hóa học tổng quát, Giáo dục đại học McGraw-Hill.
(2) Nguồn: Dean, J. A. 1999. Sổ tay hóa học của Lange, Hoa Kỳ, McGraw-Hill, Inc.
(Trang 110)
3. Tính chất vật lí
Một số thông số vật lí của kim loại nhóm IA được trình bày ở Bảng 24.2.
Bảng 24.2. Một số thông số vật lí của kim loại nhóm IA(1)
| Kim loại | Nhiệt độ nóng chảy (°C) | Nhiệt độ sôi (°C) | Khối lượng riêng (g/cm³) | Độ cứng (2) |
| Li | 180,5 | 1341 | 0,534 | 0,6 |
| Na | 97,8 | 881 | 0,968 | 0,5 |
| K | 63,4 | 759 | 0,89 | 0,4 |
| Rb | 39,3 | 691 | 1.532 | 0,3 |
| Cs | 28,4 | 668 | 1,878 | 0,2 |
Thực hiện các yêu cầu sau:
1. Nhận xét về xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của các kim loại nhóm IA.
2. Dựa vào Bảng 24.2, hãy nhận xét về khối lượng riêng và độ cứng của các kim loại nhóm IA.
a) Nhiệt độ nóng chảy và nhiệt độ sôi
Trong nhóm IA, nhiệt độ nóng chảy và nhiệt độ sôi của các kim loại có xu hướng giảm dần từ Li đến Cs.
Các kim loại nhóm IA đều dễ nóng chảy và có nhiệt độ nóng chảy thấp hơn so với các kim loại nhóm khác.
b) Khối lượng riêng
Các kim loại nhóm IA có khối lượng riêng nhỏ (đều là kim loại nhẹ) do có bán kính nguyên tử lớn và cấu trúc mạng tinh thể kém đặc khít.
c) Độ cứng
Do có liên kết kim loại yếu nên các kim loại nhóm IA có độ cứng thấp (đều mềm, có thể cắt bằng dao, kéo).
4. Tính chất hoá học
Kim loại kiềm là những kim loại hoạt động hoá học mạnh, có tính khử mạnh và tính khửtăng dần từ Li đến Cs.
Các kim loại kiềm có thế điện cực chuẩn rất âm, do đó chúng đều phản ứng với nước ở điều kiện thường với mức độ tăng dần từ Li đến Cs.
(1) Nguồn: Dean, J. A. 1999. Sổ tay hóa học của Lange, Hoa Kỳ, McGraw-Hill, Inc.
(2) Nguồn: https://webelements.com/, truy cập ngày 02 tháng 10 năm 2023 (kim cương = 10).
(Trang 111)
Lithium, sodium, potassium tác dụng với nước, chlorine, oxygen
Ba thí nghiệm về phản ứng của lithium, sodium, potassium với nước, chlorine, oxygen đã được thực hiện và quan sát thấy các hiện tượng như được mô tả dưới đây:
Hoá chất: kim loại lithium, sodium, potassium, nước.
Dụng cụ: 3 bình tam giác đựng khí oxygen, 3 bình tam giác đựng khí chlorine, 3 chậu thuỷ tinh, muôi sắt, dao, kẹp sắt.
Thí nghiệm 1: Tác dụng với nước
Tiến hành:
Cho mỗi mẫu kim loại vào một chậu thuỷ tinh chứa nước, hiện tượng xảy ra được ghi lại ở Bảng 24.3.
Bảng 24.3. Hiện tượng phản ứng của Li, Na, K với nước
| Kim loại | Hiện tượng |
| Li | Mẫu kim loại chuyển động chậm trên mặt nước. |
| Na | Mẫu kim loại trở thành khối cầu, chạy nhanh trên mặt nước. |
| K | Mẫu kim loại cháy, kèm tiếng nổ nhẹ. |
Thực hiện các yêu cầu sau:
1. So sánh mức độ phản ứng của Li, Na, K với nước.
2. Viết phương trình hoá học của các phản ứng xảy ra. Nêu cách nhận biết môi trường của các dung dịch sau phản ứng.
Thí nghiệm 2: Tác dụng với chlorine
Tiến hành:
Cho mỗi mẫu kim loại Li, Na, K vào một muôi sắt, hơ nóng trên ngọn lửa đèn cồn đến khi nóng chảy, rồi đưa nhanh vào bình đựng khí chlorine.
Hiện tượng xảy ra như sau: Các kim loại bốc cháy với mức độ tăng dần từ Li đến K.
Thực hiện yêu cầu sau:
Viết phương trình hoá học của các phản ứng xảy ra.
Thí nghiệm 3: Tác dụng với oxygen
Tiến hành:
Cho mỗi mẫu kim loại Li, Na, K vào một muôi sắt, hơ nóng trên ngọn lửa đèn cồn đến khi nóng chảy rồi đưa nhanh vào lọ đựng khí oxygen.
Hiện tượng xảy ra như sau: Các kim loại bốc cháy với mức độ tăng dần từ Li đến K.
Thực hiện yêu cầu sau:
Viết phương trình hoá học của các phản ứng xảy ra.
(Trang 112)
2. Trong phòng thí nghiệm:
a) Khi cho kim loại nhóm IA (Li, Na, K) tác dụng với nước thì cần lấy mẫu kim loại nhỏ. Giải thích.
b) Sodium được dùng để loại nước khỏi một số dung môi hữu cơ như ether. Giải thích.
5. Bảo quản
Các kim loại nhóm IA được bảo quản trong dầu hoả, trong chân không hoặc trong khí hiếm. Ví dụ: Na, K thường được bảo quản bằng cách ngâm trong dầu hoả khan; Rb, Cs thường được bảo quản trong các ống thuỷ tinh hàn kín.

Hình 24.2. Bảo quản Na, K trong dầu hoả
3.
a) Tại sao có thể bảo quản Na, K bằng cách ngâm trong dầu hoả?
b) Có thể sử dụng các alcohol (ví dụ ethanol) để bảo quản kim loại nhóm IA không? Giải thích.
II. HỢP CHẤT CỦA KIM LOẠI NHÓM IA
1. Đặc điểm chung
Các hợp chất của kim loại kiềm thường dễ tan trong nước và tạo thành dung dịch chất điện li mạnh.
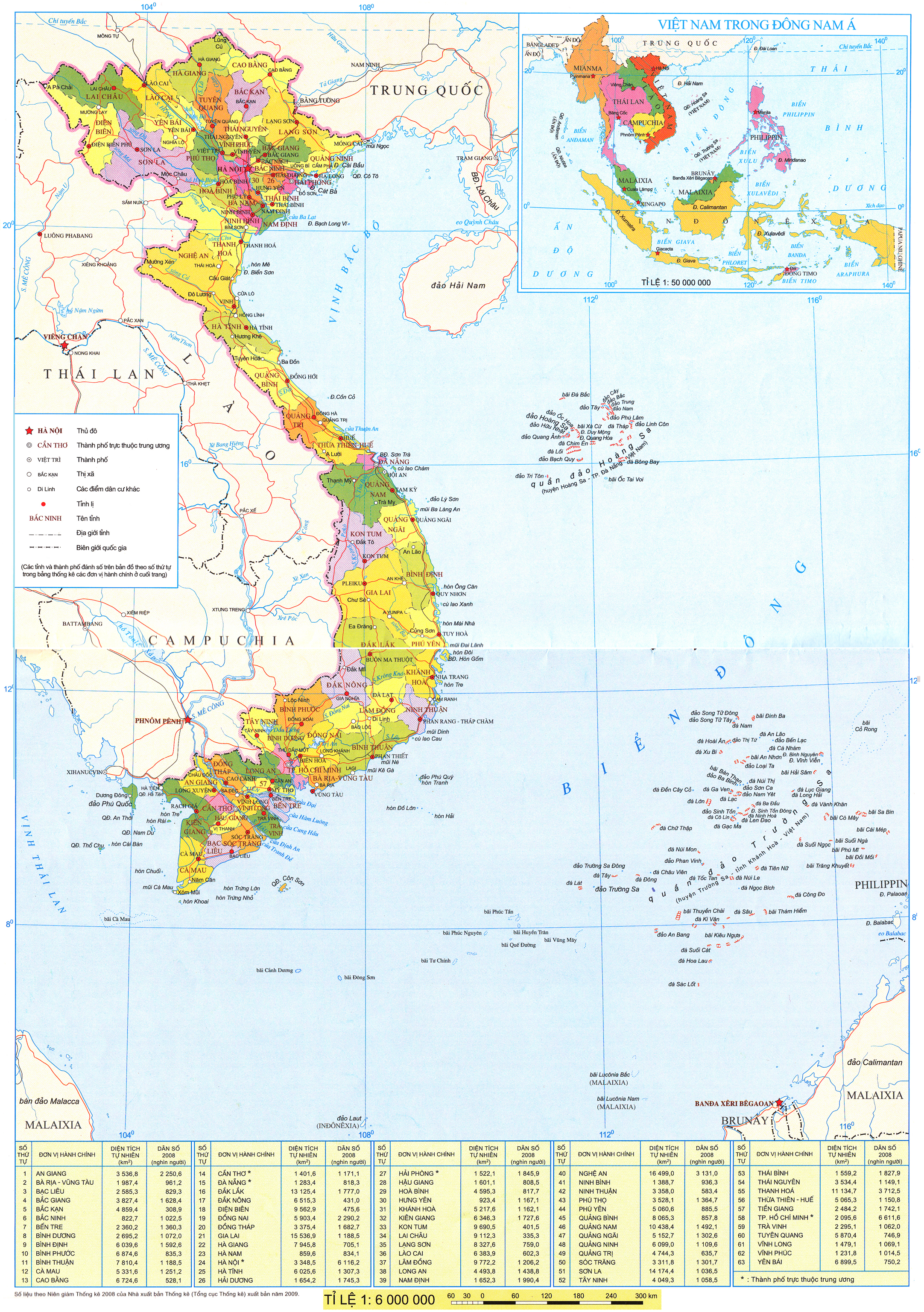
Ở nhiệt độ thường, các ion kim loại nhóm IA đều không có màu. Tuy nhiên, đốt nóng kim loại kiềm hoặc các hợp chất của chúng trên ngọn lửa không màu làm ngọn lửa có màu đặc trưng. Do vậy, có thể nhận biết hợp chất của kim loại nhóm IA bằng màu ngọn lửa.
Phân biệt các ion Li+, Na+, K+ bằng màu ngọn lửa (học sinh quan sát video thí nghiệm)
Hoá chất: các dung dịch bão hoà: LICI, NaCl, KCI.
Dụng cụ: ống nghiệm, giá ống nghiệm; dây platinum (hoặc nickel); đèn khí Bunsen (khí gas).
Tiến hành:
- Nhúng dây platinum vào ống nghiệm chứa dung dịch LiCl bão hoà.
- Hơ nóng đầu dây trên ngọn lửa đèn khí.
- Tiến hành thí nghiệm tương tự với dung dịch NaCl bão hoà và dung dịch KCI bão hoà.
Quan sát hiện tượng xảy ra qua video thí nghiệm và thực hiện yêu cầu sau:
LiCI
NaCl
KCI
Hình 24.3. Màu ngọn lửa ion kim loại nhóm IA
Nhận xét về màu ngọn lửa các ion kim loại trong thí nghiệm.
(Trang 113)
2. Hợp chất quan trọng
a) Sodium chloride
- Ứng dụng:
Một số ứng dụng của NaCl
Trong đời sống: gia vị, bảo quản và chế biến thực phẩm,...
Trong y học: nước muối sinh lí, chất điện giải,...
Trong công nghiệp hoá chất: sản xuất chlorine – kiềm, nước Javel, soda,...

- Quá trình điện phân dung dịch NaCl:
Trong công nghiệp chlorine – kiềm, quá trình điện phân dung dịch NaCl bão hoà có màng ngăn điện cực được ứng dụng để sản xuất xút công nghiệp (NaOH), khíchlorine (Cl2). Điện phân dung dịch NaCl bão hoà không có màng ngăn điện cực được ứng dụng để sản xuất nước Javel (chứa NaCIO).
Viết các quá trình oxi hoá, quá trình khử xảy ra ở mỗi điện cực và viết phương trình hoá học của quá trình điện phân dung dịch NaCl có màng ngăn.
EM CÓ BIẾT
Trong công nghiệp, quá trình điện phân dung dịch NaCl thường được tiến hành trong thùng điện phân có anode bằng than chì và cathode bằng sắt. Giữa hai điện cực có màng ngăn xốp để ngăn không cho Cl₂ tiếp xúc với OH.
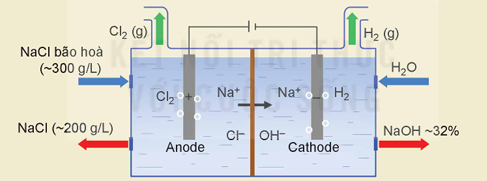
Hình 24.4. Sơ đồ quá trình điện phân dung dịch NaCl
trong công nghiệp chlorine – kiềm
(Nguồn: Millet, P. 2013. 9 - Công nghệ clo-kiềm: nguyên tắc cơ bản, quy trình và vật liệu cho màng ngăn và màng. Trong: Basile, A. (biên tập) Sổ tay lò phản ứng màng - Các loại lò phản ứng và ứng dụng công nghiệp. Elsevier Science.)
(Trang 110)
Nước muối bão hoà
CO2
Tháp carbonate hoá
làm lạnh, lọc
Sản phẩm NaHCO3(s)
Sản phẩm Na2CO3(s)
NH3
NH4Cl(dung dịch)
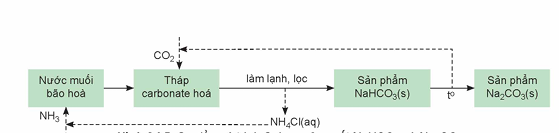
Hình 24.5. Sơ đồ quá trình Solvay sản xuất NaHCO3 và Na2CO3
4.
a) Trong quá trình Solvay, viết các phương trình hoá học của phản ứng:
- Nung vôi để cung cấp vôi sống và carbon dioxide.
- Tái chế ammonia từ vôi sống và dung dịch ammonium chloride.
b) Quy trình Solvay đã giảm thiểu được tác động đến môi trường bằng cách quay vòng các sản phẩm trung gian (như CO2 và NH3) để tái sử dụng trong quy trình sản xuất.
Từ sơ đồ quá trình Solvay, hãy làm sáng tỏ nhận định trên.
EM ĐÃ HỌC
- Kim loại nhóm IA chỉ tồn tại trong tự nhiên ở dạng hợp chất.
- Kim loại nhóm IA mềm, khối lượng riêng nhỏ, nhiệt độ nóng chảy và nhiệt độ sôi thấp.
- Kim loại nhóm IA có tính khử mạnh. Mức độ phản ứng với nước, chlorine và oxygen tăng dần trong dãy lithium, sodium, potassium.
- Các ion kim loại nhóm IA cho màu ngọn lửa đặc trưng: ion Li+ màu đỏ tía, ion Na+ màu vàng, ion K+ màu tím nhạt.
- Các kim loại kiềm thường được bảo quản bằng cách ngâm trong dầu hoả, trong chân không hoặc trong khí hiếm.
- Sodium chloride là nguyên liệu sản xuất chlorine, kiềm bằng phương pháp điện phân dung dịch.
- Sodium hydrogencarbonate và sodium carbonate được sản xuất bằng phương pháp Solvay. Chúng được sử dụng trong công nghệ thực phẩm, dược phẩm, hoá chất, xử lí nước,...
EM CÓ THỂ
- Bảo quản các kim loại kiềm đúng cách.
- Giải thích được cơ sở của quá trình sản xuất chlorine – kiềm, quá trình Solvay.