(Trang 103)

Người dân làm muối từ nước biển
Tên gọi chung của các nguyên tố nhóm VIIA là halogen. Theo tiếng Hy Lạp “hals” là muối và “genes” là sinh ra, halogen nghĩa là sinh ra muối. Sodium chloride (NaCl) là hợp chất quan trọng và phổ biến của chlorine trong tự nhiên, có nhiều trong nước biển và mỏ muối. Biển và đại dương là kho vô tận chứa các muối halide, vừa là môi trường sống của nhiều loài sinh vật, vừa là đối tượng khai thác, chế biến của nhiều ngành nghề.
| • Nhóm halogen • Hydrogen halide. Muối halide • Ôn tập |
(Trang 104)
MỤC TIÊU:
– Nêu được trạng thái tự nhiên của các nguyên tố halogen.
– Mô tả được trạng thái, màu sắc, nhiệt độ nóng chảy, nhiệt độ sôi của các đơn chất halogen.
– Giải thích được sự biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của các đơn chất halogen dựa vào tương tác van der Waals.
– Trình bày được xu hướng các halogen nhận thêm 1 electron (từ kim loại) hoặc dùng chung electron (với phi kim) để tạo hợp chất ion hoặc hợp chất cộng hoá trị dựa theo cấu hình electron. Giải thích được xu hướng phản ứng của các đơn chất halogen với hydrogen.
– Viết được phương trình hoá học của phản ứng tự oxi hoá – khử của chlorine.
– Thực hiện được (hoặc quan sát video) một số thí nghiệm chứng minh tính oxi hoá mạnh của các halogen và so sánh tính oxi hoá của các halogen trong nhóm VIIA.
| Trong tự nhiên, một số phi kim như carbon, nitrogen, oxygen tồn tại ở cả dạng đơn chất và hợp chất, còn các halogen đều chỉ tồn tại ở dạng hợp chất. Vì sao có sự khác biệt này? |
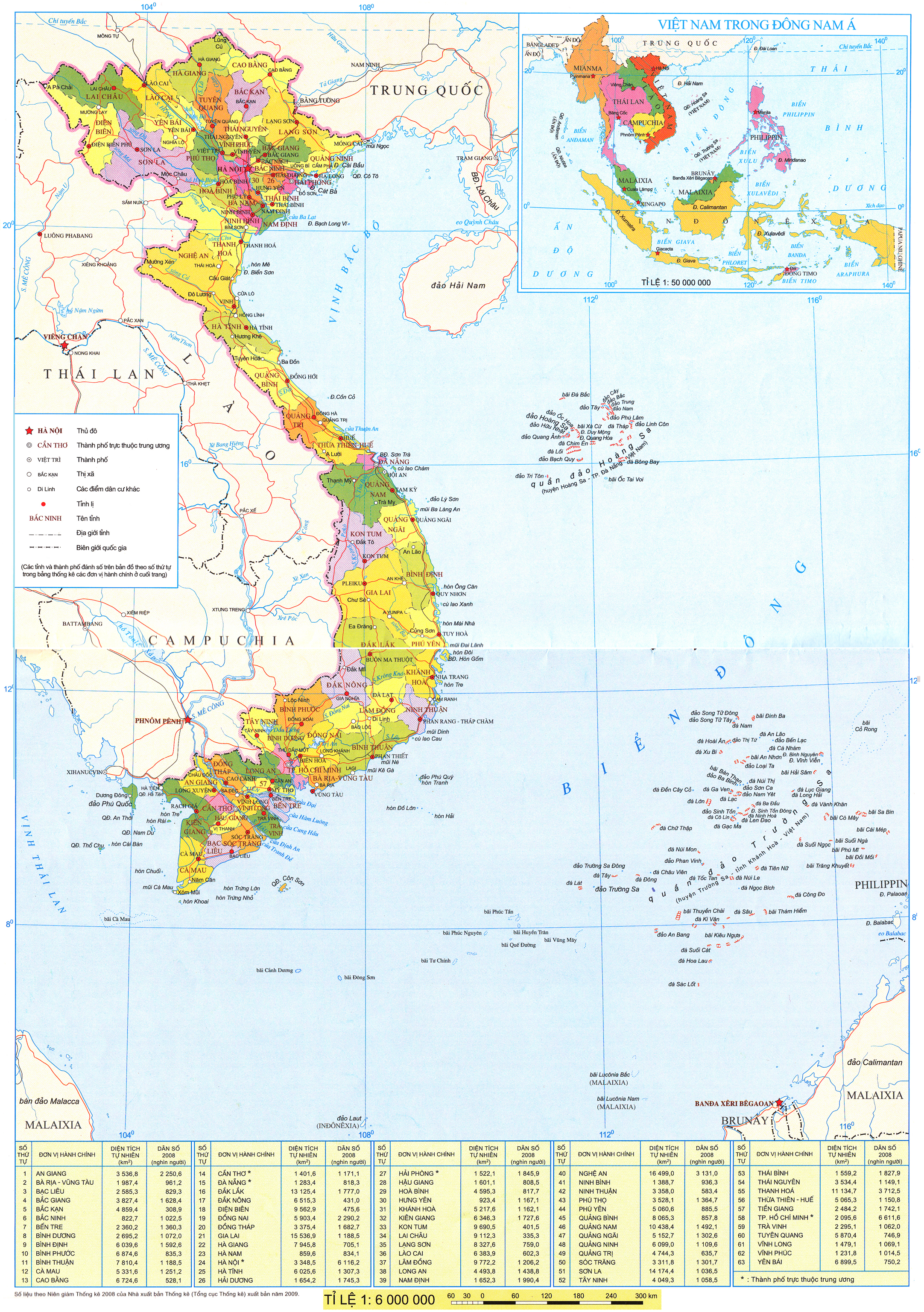
I. TRẠNG THÁI TỰ NHIÊN
Nhóm VIIA trong bảng tuần hoàn các nguyên tố hoá học còn gọi là nhóm halogen, gồm sáu nguyên tố: fluorine (F), chlorine (CI), bromine (Br), iodine (I), astatine (At) và tennessine (Ts). Bốn nguyên tố F, Cl, Br và I tồn tại trong tự nhiên, còn At và Ts là các nguyên tố phóng xạ.
Trong tự nhiên, halogen chỉ tồn tại ở dạng hợp chất, phần lớn ở dạng muối halide, phổ biến nhu calcium fluoride, sodium chloride.
| Bảng 21.1. Nồng độ các ion halide trong nước biển (*)
Trong cơ thể người, nguyên tố chlorine có trong máu và dịch vị dạ dày (ở dạng ion | Hình 21.1. Rong biển chứa nguyên tố iodine |
(*) Nguồn: John Wright, Angela Colling (2004). Seawater: Its Composition, Properties and Behaviour. The Open University.
(Trang 105)
| EM CÓ BIẾT Muối mỏ Ngoài khai thác chủ yếu từ nước biển, muối ăn còn được khai thác từ mỏ muối. Muối mỏ có nhiều ứng dụng, ví dụ đá muối Himalaya (Hình 21.2) được sử dụng trong ẩm thực, chăm sóc sức khoẻ, sắc đẹp, trang trí nội thất,... |
Hình 21.2. Đá muối Himalaya |
| 1. Kể tên một số hợp chất phổ biến của halogen trong tự nhiên. |
II. CẤU TẠO NGUYÊN TỬ, PHÂN TỬ
1. Tra cứu số liệu Bảng 6.1, Bảng 6.2 và Hình 6.2 để hoàn thành bảng mô tả một số đặc điểm cấu tạo của các nguyên tử halogen theo mẫu sau:
| Nguyên tử | Lớp electron ngoài cùng | Bán kính nguyên tử | Độ âm điện |
| Fluorine | ? | ? | ? |
| Chlorine | ? | ? | ? |
| Bromine | ? | ? | ? |
| lodine | ? | ? | ? |
Từ bảng số liệu thu được hãy:
a) Giải thích tại sao nguyên tử halogen có xu hướng nhận 1 electron từ nguyên tử kim loại, hoặc góp chung 1 electron với nguyên tử phi kim, để hình thành liên kết.
b) Nêu và giải thích xu hướng biến đổi bán kính nguyên tử, độ âm điện của các nguyên tử halogen. Từ đó dự đoán xu hướng biến đổi tính oxi hoá từ F đến I.
c) Dựa vào cấu hình electron lớp ngoài cùng và độ âm điện, giải thích tại sao nguyên tử fluorine chỉ có số oxi hoá −1 trong các hợp chất?
2. Tham khảo Bài 12 (Liên kết cộng hoá trị), hãy:
a) Mô tả sự hình thành liên kết trong phân tử halogen bằng công thức electron.
b) Liên kết trong phân tử halogen là liên kết cộng hoá trị phân cực hay không phân cực?
c) Dựa vào bán kính nguyên tử (Hình 6.2), hãy dự đoán xu hướng biến đổi độ dài liên kết trong dãy các phân tử halogen.
(Trang 106)
Các nguyên tử halogen có 7 electron ở lớp ngoài cùng, dễ nhận thêm 1 electron để đạt được cấu hình electron bền của khí hiếm gần nhất:
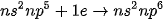
Do vậy, số oxi hoá đặc trưng của các halogen trong hợp chất là −1.
Tuy nhiên, khi liên kết với các nguyên tố có độ âm điện lớn, các halogen có thể có các số oxi hoá dương: +1, +3, +5, +7 (trừ fluorine có độ âm điện lớn nhất, nên fluorine luôn có số oxi hoá bằng −1 trong mọi hợp chất).
| 1. Xác định số oxi hoá của chlorine trong các chất sau: 2. Từ các số oxi hoá của chlorine, hãy giải thích tại sao |
| EM CÓ BIẾT Đồng vị phóng xạ trong y học • Kĩ thuật chụp PET-CT nhằm phát hiện vị trí các tế bào có tốc độ tiêu thụ glucose lớn, thường là tế bào ung thư. Dược chất • Đồng vị phóng xạ |
Hình 21.3. Thiết bị chụp PET-CT |
| 2. Trong tự nhiên, các nguyên tố halogen tồn tại ở dạng hợp chất. Viết công thức một vài hợp chất của halogen thường được dùng trong thực tế. 3. Nguyên tử halogen có thể nhận 1 electron từ nguyên tử kim loại hoặc góp chung electron với nguyên tử phi kim. Hãy mô tả sự hình thành liên kết trong phân tử NaCl và HCI để minh hoạ. |
(Trang 107)
II. TÍNH CHẤT VẬT LÍ
Trạng thái tồn tại, màu sắc, nhiệt độ nóng chảy 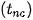 , nhiệt độ sôi
, nhiệt độ sôi 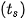 của halogen được trình bày ở Bảng 21.2:
của halogen được trình bày ở Bảng 21.2:
Bảng 21.2. Một số tính chất vật lí của đơn chất halogen (*)
| Đơn chất | Trạng thái | Màu sắc | 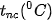 | 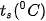 | Độ tan trong nước (mol/L) (ở 25 °C) |
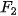 | Khí | Lục nhạt | –219,6 | –188,1 | – |
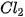 | Khí | Vàng lục | –101,0 | –34,1 | 0,091 |
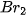 | Lỏng | Nâu đỏ | –7,3 | 59,2 | 0,21 |
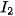 | Rắn | Tím đen | 113,6 | 185,5 | 0,0013 |
| Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ • Tương tác van der Waals giữa các phân tử tăng. • Khối lượng phân tử tăng. Ở điều kiện thường, các halogen ít tan trong nước nhưng tan nhiều trong dung môi hữu cơ như alcohol, benzene. Trong y học, dung dịch iodine loãng trong ethanol được dùng làm thuốc sát trùng. Bromine gây bỏng sâu khi tiếp xúc với da. Hít thở không khí có chứa halogen với nồng độ vượt ngưỡng cho phép làm tổn hại niêm mạc tế bào đường hô hấp, gây co thắt phế quản, khó thở. | EM CÓ BIẾT lodine thăng hoa Ở nhiệt độ cao, iodine thăng hoa, chuyển từ thể rắn sang thể hơi dưới áp suất thường.
Hình 21.4. Sự thăng hoa của iodine |
| 4. Từ Bảng 21.2, nhận xét xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của các halogen và giải thích. |
IV. TÍNH CHẤT HOÁ HỌC
Halogen là các phi kim điển hình, có tính oxi hoá mạnh, tính oxi hoá giảm dần từ fluorine đến iodine.
1. Tác dụng với kim loại
Các halogen phản ứng trực tiếp với nhiều kim loại, tạo muối halide.
--------------------------------------------------------------------------------
(*) Nguồn: http://chem.libritexts.org.
(Trang 108)
| Sodium nóng chảy sẽ cháy với ngọn lửa sáng chói trong khí chlorine, tạo thành sodium chloride:
Dây sắt (iron) nung đỏ sẽ bốc cháy trong khí chlorine, tạo thành khói màu nâu đỏ là iron(III) chloride (Hình 21.5)
5. Xác định chất oxi hoá, chất khử trong phản ứng của sodium và iron với chlorine, dùng mũi tên chỉ rõ sự nhường electron từ chất khử sang chất oxi hoá. |
Hình 21.5. Chlorine tác dụng với dây sắt (iron) ở nhiệt độ cao |
2. Tác dụng với hydrogen
Các halogen phản ứng với hydrogen, tạo thành hydrogen halide.
Bảng 21.3. Một số đặc điểm của phản ứng giữa halogen và hydrogen
| Phản ứng | Điều kiện | Đặc điểm phản ứng |
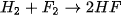 | Phản ứng ngay ở nhiệt độ phòng và trong bóng tối | Nổ mạnh |
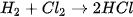 | Ánh sáng hoặc t° | Gây nổ |
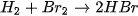 | ~ 200 °C, xúc tác Pt | Không gây nổ |
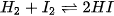 | ~ 300 °C, xúc tác Pt | Thuận nghịch (*) |
Mức độ phản ứng của các halogen với hydrogen giảm dần khi đi từ fluorine đến iodine, phù hợp với tính oxi hoá của các halogen giảm dần từ 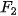 đến
đến 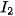 .
.
| Xét các phản ứng hoá học: 1. Giải thích xu hướng phản ứng của các đơn chất halogen với hydrogen theo khả năng hoạt động của các halogen. 2. Dựa vào số liệu năng lượng liên kết H–X, giải thích xu hướng phản ứng giảm dần từ |
---------------------------------------------------------------------------------
(*) Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều trái ngược nhau ở cùng điều kiện.
(Trang 109)
3. Tác dụng với nướcKhi tan vào nước, một phần
Hypochlorous acid có tính oxi hoá mạnh nên chlorine trong nước có khả năng diệt khuẩn, tẩy màu và được ứng dụng trong khử trùng nước sinh hoạt. | EM CÓ BIẾT
Các halogen |
6. Một nhà máy nước sử dụng 5 mg 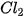 để khử trùng 1 L nước sinh hoạt. Tính khối lượng để khử trùng 1 L nước sinh hoạt. Tính khối lượng 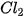 nhà máy cần dùng để khử trùng nhà máy cần dùng để khử trùng 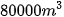 nước sinh hoạt. nước sinh hoạt. |
| Tìm hiểu tính tẩy màu của khí chlorine ẩm Tiến hành: Đính một mẫu giấy màu ẩm vào dây kim loại gắn với nút đậy bình tam giác. Sau đó, đưa mẫu giấy vào bình tam giác chứa khí chlorine (Hình 21.6). Quan sát hiện tượng và thực hiện yêu cầu sau: 1. Nhận xét màu của mẫu giấy trước và sau khi cho vào bình tam giác. Giải thích. 2. Xác định vai trò của chlorine trong phản ứng với nước, tại sao nói chlorine tự oxi hoá – tự khử trong phản ứng này? |
Hình 21.6. Tính tẩy màu của khí chlorine ẩm Mẫu giấy màu ẩm ban đầu Mẫu giấy màu Khí |
4. Tác dụng với dung dịch kiềm
Chlorine phản ứng với dung dịch sodium hydroxide ở điều kiện thường, tạo thành nước Javel (Gia-ven):
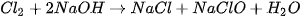
Nước Javel (chứa NaCIO (sodium hypochlorite), NaCl và một phần NaOH dư) được dùng làm chất tẩy rửa, khử trùng.
Khi đun nóng, 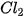 phản ứng với dung dịch potassium hydroxide tạo thành muối chlorate:
phản ứng với dung dịch potassium hydroxide tạo thành muối chlorate:
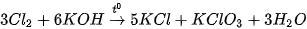
Potassium chlorate là chất oxi hoá mạnh, được sử dụng chế tạo thuốc nổ, hỗn hợp đầu que diêm,...
(Trang 110)
| 7. Khí Lập phương trình hoá học của phản ứng trên theo phương pháp thăng bằng electron, chỉ rõ chất oxi hoá, chất khử. |
5. Tác dụng với dung dịch halide
Chlorine có thể oxi hoá ion 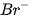 trong dung dịch muối bromide và ion
trong dung dịch muối bromide và ion 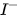 trong dung dịch muối iodide, bromine có thể oxi hoá ion
trong dung dịch muối iodide, bromine có thể oxi hoá ion 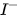 trong dung dịch muối iodide.
trong dung dịch muối iodide.
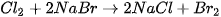
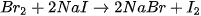
Trong công nghiệp, phản ứng giữa chlorine và ion bromide được ứng dụng để điều chế bromine từ nước biển.
| Phản ứng thế của một số muối halide Chuẩn bị: 3 ống nghiệm, dung dịch NaBr, dung dịch Nal, nước Tiến hành: • Lấy khoảng 2 mL dung dịch NaBr vào ống nghiệm (1), 2 mL dung dịch Nal vào mỗi ống nghiệm (2) và (3). Thêm vào ống nghiệm (1) và (2) vài giọt nước Lưu ý: Cẩn thận không để nước
Hình 21.7. Phản ứng thế của một số muối halide Nước Nước Dung dịch NaBr Dung dịch Nal Ống (1) Ống (2) Ống (3) Quan sát hiện tượng và thực hiện yêu cầu sau: 1. Nhận xét sự thay đổi màu của dung dịch trong các ống nghiệm. 2. So sánh tính oxi hoá của 3. Hãy chọn một thuốc thử để chứng tỏ có sự tạo thành |
8. Viết phương trình hoá học minh hoạ tính oxi hoá giảm dần trong dãy 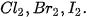 |
(Trang 111)
V. ĐIỀU CHẾ CHLORINE
Năm 1774, C. W. Scheele (Se-lơ), nhà hoá học người Thụy Điển, điều chế được chlorine khi cho quặng pyrolusite 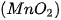 tác dụng với hydrochloric acid đặc:
tác dụng với hydrochloric acid đặc:
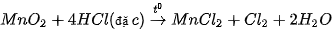
Ngày nay, phản ứng trên vẫn được dùng khi cần điều chế khí 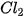 trong phòng thí nghiệm. Ngoài ra, còn có thể thay
trong phòng thí nghiệm. Ngoài ra, còn có thể thay 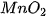 bằng
bằng 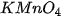 rắn để điều chế khí
rắn để điều chế khí 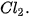
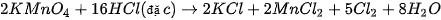
Trong công nghiệp, chlorine được sản xuất ở nhiệt độ thường bằng cách điện phân dung dịch muối ăn bão hoà, có màng ngăn giữa các điện cực:
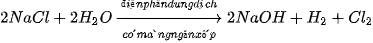
9. Khi sản xuất chlorine trong công nghiệp, NaOH và 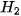 được tạo thành ở cực âm, còn được tạo thành ở cực âm, còn 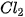 được tạo thành ở cực dương. Tại sao cần sử dụng màng ngăn xốp để ngăn cách hai điện cực? được tạo thành ở cực dương. Tại sao cần sử dụng màng ngăn xốp để ngăn cách hai điện cực? |
| EM ĐÃ HỌC • Các nguyên tố halogen tồn tại trong tự nhiên ở dạng hợp chất, phổ biến là muối của fluorine và chlorine. • Các đơn chất halogen từ fluorine đến iodine: – Nhiệt độ nóng chảy tăng dần, nhiệt độ sôi tăng dần. – Là phi kim điển hình, tính oxi hoá giảm |
| EM CÓ THỂ • Thực hiện được thí nghiệm chứng minh và so sánh tính oxi hoá của đơn chất halogen. • Sử dụng nước Javel an toàn. |
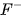
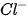
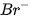
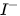


 vừa có tính oxi hoá vừa có tính khử?
vừa có tính oxi hoá vừa có tính khử?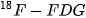 dùng trong chụp PET-CT được tạo ra khi thay thế một nhóm OH trong phân tử glucose bằng nguyên tử đồng vị đánh dấu
dùng trong chụp PET-CT được tạo ra khi thay thế một nhóm OH trong phân tử glucose bằng nguyên tử đồng vị đánh dấu 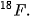
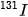 dùng điều trị một số bệnh lí tuyến giáp như cường giáp tự miễn (Basedow), ung thư tuyến giáp.
dùng điều trị một số bệnh lí tuyến giáp như cường giáp tự miễn (Basedow), ung thư tuyến giáp.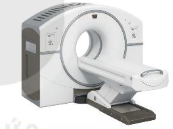

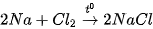
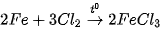

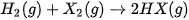 (X là các halogen).
(X là các halogen).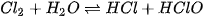
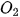 :
: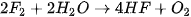
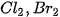 và
và 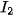 phản ứng chậm với nước và mức độ phản ứng giảm dần từ
phản ứng chậm với nước và mức độ phản ứng giảm dần từ 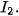

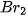 loãng.
loãng.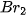 , lắc đều các ống nghiệm.
, lắc đều các ống nghiệm.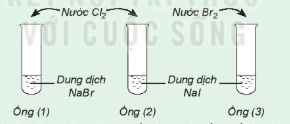
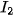 khi cho nước chlorine (hoặc nước bromine) tác dụng với dung dịch sodium iodide.
khi cho nước chlorine (hoặc nước bromine) tác dụng với dung dịch sodium iodide.