Biết đánh giá độ axit và độ kiểm của các dung dịch theo nồng độ ion H* và pH.
Biết màu của một số chất chí thị trong dung dịch ở các khoáng pH khác nhau.
I - NƯỚC LÀ CHẤT ĐIỆN LI RẤT YẾU
1. Sự điện li của nước
Bằng dụng cụ đo nhạy, người ta thấy nước cũng dẫn điện nhưng cực kì yếu.
Nước điện li rất yếu :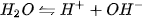 (1)
(1)
Thực nghiệm đã xác định được rằng, ở nhiệt độ thường cứ 555 triệu phân tử 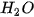 chỉ có một phân tử phân li ra ion.
chỉ có một phân tử phân li ra ion.
2. Tích số ion của nước
Từ phương trình điện li của 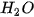 (1). ta thấy một phân tử
(1). ta thấy một phân tử 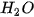 phân li ra một ion
phân li ra một ion 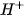 và một ion
và một ion 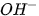 , nghĩa là trong nước nồng độ
, nghĩa là trong nước nồng độ 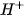 bằng nồng độ
bằng nồng độ 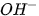 .
.
Nước có môi trường trung tính, nên có thể định nghĩa :
Môi trường trung tính là môi trường trong đó [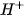 ] = [
] = [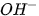 ].
].
Bằng thực nghiệm, người ta đã xác định được nồng độ của chúng như sau :
[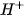 ] = [
] = [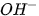 ] =
] = 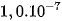 (mol/l) ở
(mol/l) ở 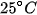
Đặt 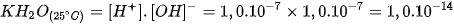
Tích số 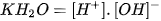 được gọi là tích số ion của nước. Tích số này là hằng số ở nhiệt độ xác định, tuy nhiên giá trị tích số ion của nước là
được gọi là tích số ion của nước. Tích số này là hằng số ở nhiệt độ xác định, tuy nhiên giá trị tích số ion của nước là 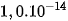 thường được dùng trong các phép tính, khi nhiệt độ không khác nhiều với
thường được dùng trong các phép tính, khi nhiệt độ không khác nhiều với  .
.
Một cách gần đúng, có thể coi giá trị tích số ion của nước là hằng số cả trong dung dịch loãng của các chất khác nhau.
3. Ý nghĩa tích số ion của nước
a. Môi trường axit
Khi hoà tan axit vào nước, nồng độ 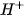 tăng, vì vậy nồng độ
tăng, vì vậy nồng độ 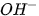 phải giảm sao cho tích số ion của nước không đổi. Thí dụ, hoà tan axit HCI vào nước để nồng độ
phải giảm sao cho tích số ion của nước không đổi. Thí dụ, hoà tan axit HCI vào nước để nồng độ 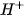 bằng
bằng 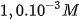 , thì nồng độ
, thì nồng độ 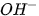 là :
là :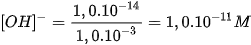
Vậy môi trường axit là môi trường trong đó :
[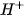 ]>[
]>[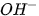 ] hay [
] hay [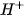 ] >
] > 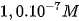
b. Môi trường kiềm
Khi hoà tan bazơ vào nước, nồng độ 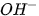 tăng, vì vậy nồng độ
tăng, vì vậy nồng độ 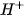 phải giảm sao cho tích số ion của nước không đổi. Thí dụ, hoà tan bazơ vào nước để nồng
phải giảm sao cho tích số ion của nước không đổi. Thí dụ, hoà tan bazơ vào nước để nồng
độ 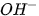 bằng 1,0.10FŸM thì nồng độ
bằng 1,0.10FŸM thì nồng độ 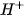 là :
là :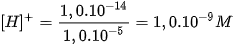
Vậy môi trường kiềm là môi trường trong đó :
[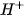 ]>[
]>[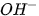 ] hay [
] hay [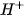 ] <
] < 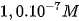
Những thí dụ trên cho thấy, nếu biết nồng độ 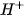 trong dung dịch nước thì nồng độ
trong dung dịch nước thì nồng độ 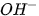 cũng được xác định và ngược lại. Vì vậy, độ axit và độ kiêm của dung dịch có thể được đánh giá chỉ bằng nồng độ
cũng được xác định và ngược lại. Vì vậy, độ axit và độ kiêm của dung dịch có thể được đánh giá chỉ bằng nồng độ 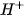 :
:
Môi trường trung tính : 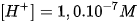 .
.
Môi trường axit : 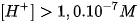 .
.
Môi trường kiểm : 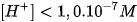 .
.
II - KHÁI NIỆM VỀ pH. CHẤT CHÍ THỊ AXIT - BAZƠ
1. Khái niệm về pH
Như đã thấy ở trên, có thể đánh giá độ axit và độ kiểm của dung dịch bằng nồng độ 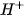 . Nhưng dung dịch thường dùng có nồng độ
. Nhưng dung dịch thường dùng có nồng độ 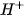 nhỏ. Để tránh ghi nồng độ
nhỏ. Để tránh ghi nồng độ 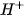 với số mũ âm, người ta dùng giá trị pH với quy ước như sau :
với số mũ âm, người ta dùng giá trị pH với quy ước như sau :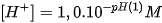 . Nếu
. Nếu 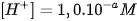 thì pH = a
thì pH = a
Thí dụ :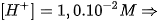 pH=2,00: môi trường axit
pH=2,00: môi trường axit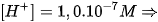 pH=7,00: môi trường trung tính.
pH=7,00: môi trường trung tính.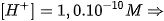 pH=10,00: môi trường kiềm.
pH=10,00: môi trường kiềm.
Thang pH thường dùng có giá trị từ 1 đến 14.
Giá trị pH có ý nghĩa to lớn trong thực tế. Chẳng hạn, pH của máu người và động vật có giá trị gần như không đổi. Thực vật chỉ có thể sinh trưởng bình thường khi giá trị pH của dung dịch trong đất ở trong khoảng xác định đặc trưng cho mỗi loại cây. Tốc độ ăn mòn kim loại trong nước tự nhiên phụ thuộc rất nhiều vào giá trị pH của nước mà kim loại tiếp xúc.
2. Chất chí thị axit - bazơ
Chất chỉ thị axit — bazơ là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch.
Thí dụ, màu của hai chất chỉ thị axit — bazơ là guỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau được đưa ra trong bảng 1.1.
Bảng 1.1. Màn của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau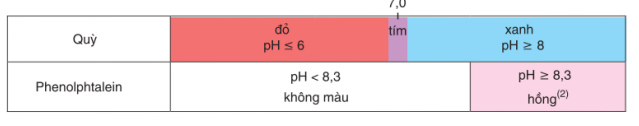
(1) Về mặt toán học pH = -lg[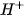 ].
].
(2) Trong xút đặc, màu hồng bị mất.
Trộn lẫn một số chất chỉ thị có màu biến đổi kế tiếp nhau theo giá trị pH,
ta được hỗn hợp chất chỉ thị vạn năng. Dùng băng giấy tẩm dung dịch hỗn hợp
này có thể xác định được gần đúng giá trị pH của dung dịch (hình 1.2).
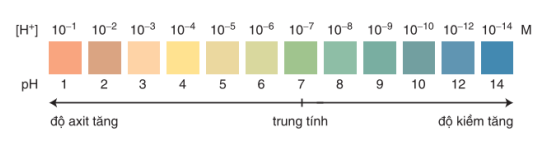
Hình 1.2. Màu của chất chỉ thị vạn năng (thuốc thứ MERCK của Đức) ở các giá trị pH khác nhau
Để xác định tương đối chính xác giá trị pH của dung dịch, người ta dùng máy đo pH.
BÀI TẬP
Tính số ion của nước là gì và bằng bao nhiêu ở 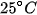 ?
?
Phát biểu các định nghĩa môi trường axit, trung tính và kiềm theo nồng độ 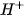 và pH.
và pH.
Chất chỉ thị axit - bazơ là gì ? Hãy cho biết màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau.
Một dung dịch có 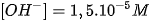 . Môi trường của dung dịch này là
. Môi trường của dung dịch này là
A. axit
B. trung tính
C. kiềm
D. không xác định được
Tính nồng độ 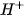 ,
, 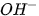 và pH của dung dịch HCI 0,10M và dung dịch NaOH 0,010M.
và pH của dung dịch HCI 0,10M và dung dịch NaOH 0,010M.
Trong dung dịch HCI 0,010M, tích số ion của nước là
A. 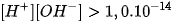
B. 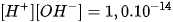
C. 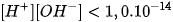
D. không xác định được.
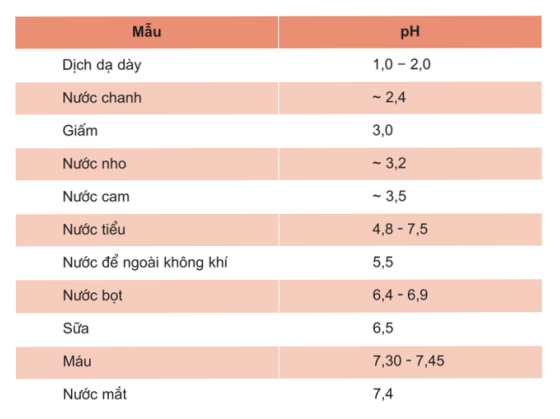
Tư liệu: GIÁ TRỊ pH CỦA MỘT SỐ DỊCH LỎNG THÔNG THƯỜNG